Una voluntaria recibe una dosis de la vacuna de AstraZeneca. Reuters
Todo lo que debes saber sobre la seguridad de la vacuna de Oxford
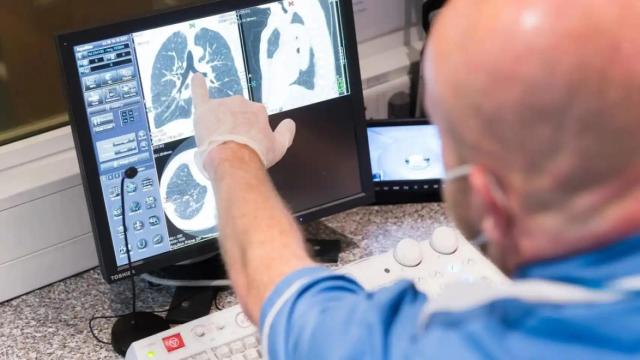
Un pediatra que forma parte del equipo de investigación clínica de la vacuna de AstraZeneca explica por qué se han parado los ensayos y eso es bueno.
14 septiembre, 2020 01:40Noticias relacionadas
Esta semana ha sido una montaña rusa en lo que se refiere a noticias sobre la que hasta se consideraba una de las vacunas más avanzadas para prevenir la infección por el coronavirus Sars CoV-2, la desarrollada conjuntamente por la Universidad de Oxford y AstraZeneca.
En la mañana del lunes, en el I Observatorio de la Sanidad organizado por EL ESPAÑOL e INVERTIA, el ministro de Sanidad, Salvador Illa, anunciaba las dosis de las que iba a disponer España de esta inmunización, la primera que ha comprado en fondo común europeo del que España forma parte.
En concreto, a España le corresponderían tres millones de vacunas para diciembre pero, como aclaró muy bien el titular de Sanidad, eso sería así "sólo si superan los análisis clínicos y con garantías".
A última hora del martes, una exclusiva de la web de medicina Stat suponía un jarro de agua fría para los que soñaban con empezar a vacunarse en diciembre en España. La farmacéutica AstraZeneca anunciaba la suspensión temporal de todos sus ensayos clínicos con su vacuna al haberse detectado un efecto adverso grave -mielitis transversa, según se supo después- en uno de sus participantes.
Pero frente al bajón que produjo en un primer momento la noticia -porque es indudable que retrasará la llegada del producto al mercado-, pronto los expertos le dieron la vuelta: lo que había pasado con la vacuna sólo era una prueba de cuán estrechamente se vigilaban los efectos secundarios y de cómo la compañía era la primera interesada -a pesar de las presiones de dirigentes como Donald Trump- en no lanzar al mercado un producto con todas las garantías de eficacia y seguridad.
Para concluir la semana, el sábado AstraZeneca anunciaba que reanudaba los ensayos con la vacuna. Sin dar detalles sobre el efecto adverso detectado y su evolución, sí lanzaba un mensaje claro: es seguro continuar con las pruebas.
Un investigador del University Hospital Southampton que participa en estos test ha explicado en Twitter todas las medidas que se llevan a cabo en los ensayos clínicos de la vacuna para que un efecto adverso nunca pueda pasar desapercibido a los científicos. Y para que pase lo que acaba de suceder, un contratiempo con final feliz.
I have the great privilege of working on the Oxford #COVID19 vaccine trials
— Alasdair Munro (@apsmunro) September 9, 2020
Safety is the top concern in all vaccine trials, and we go to great lengths to ensure the vaccine is safe to use, and to keep our trial participants safe
Here are some of the ways we do that
1/8
El pediatra Alasdair Munro comienza diciendo que la seguridad es la principal preocupación en todos los ensayos de vacunas y que se hace absolutamente todo para asegurar que la vacuna es segura y para que los participantes en los ensayos no corran ningún riesgo.
Pero, ¿en qué se traduce esta declaración de intenciones? En primer lugar, explica, todos los voluntarios reciben un número de teléfono que funciona las 24 horas al día y los 365 días el año, al que se les anima a llamar ante cualquier preocupación médica sin importar la magnitud. Desde ese número, se les deriva al servicio médico apropiado y se registran todos los síntomas y eventos de cualquier participante.
Pero si esta fuera la única forma de control, no sería suficiente. No todo el mundo considera que un síntoma es un síntoma ni reconoce que las molestias que siente son anormales. Por esta razón, cada vez que reciben una dosis, los participantes han de escribir en un diario todo lo que sienten, sea o no importante. Esta información llega a los investigadores, que la revisan y comprueban si es esperable o no -algunos efectos secundarios leves están dentro de lo esperado- y toman medidas si no lo es.
Además, los investigadores se reúnen frecuentemente con los participantes en entrevistas cara a cara. En ellas, vuelven a repasar el diario y les preguntan por todo. "Si han tomado paracetamol porque les ha dolido la cabeza, queda registrado; si lo que han consumido es un antihistamínico porque estornudaban, también", señala Munro.
Más allá de eso, si un voluntario es hospitalizado por cualquier razón -por ejemplo, porque se ha tropezado y se ha caído- , inmediatamente se revisa todo su historia y se avisa al supervisor concreto de ese paciente, que hablará directamente con él.
En muchos casos, el ingreso no tiene nada que ver con la vacunación pero, si se piensa que es así, se organiza una reunión entre el investigador del ensayo y los médicos que le atienden, todo en busca de una posible asociación entre el fármaco y el síntoma o evento.
En el momento en que hay alguna duda de que lo que ha pasado puede tener que ver con la vacuna, los ensayos de la misma se paralizan hasta que se recopila y revisa toda la información relevante para asegurar que es seguro continuar con el estudio. Estas revisiones, escribe el pediatra, son "extremadamente rigurosas".
El especialista concluye afirmando que en un ensayo clínico en el que participan decenas o miles de pacientes, es habitual suspenderlos para revisar eventos médicos que podrían haber pasado aunque el que los sufra no estuviera participando en el ensayo. Pero nadie se arriesga. "La seguridad es lo primero y trabajamos duro para asegurarnos de que el producto es seguro", concluye.