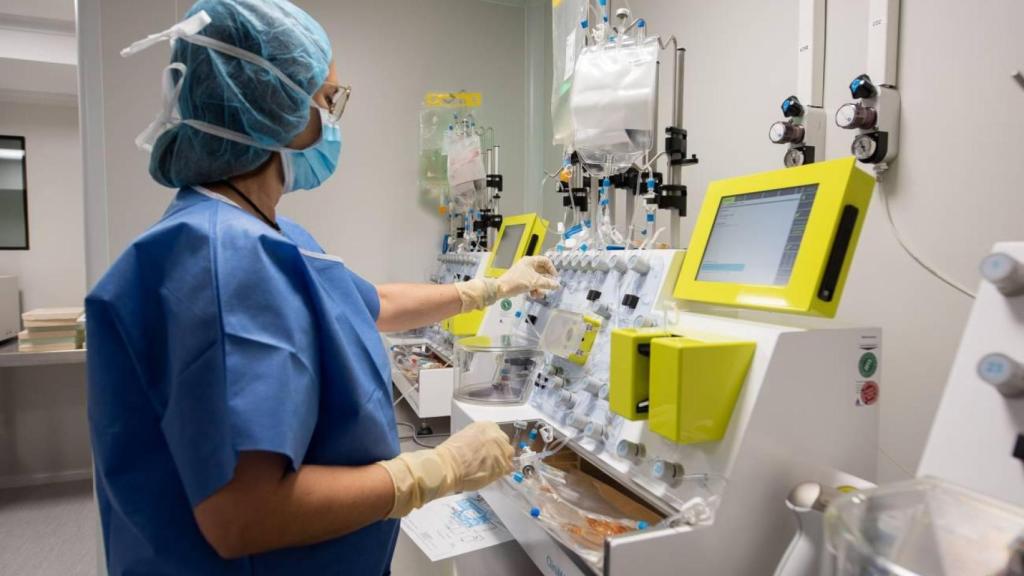
La preparación de las terapias CAR-T se realiza en unos entornos especiales denominados salas blancas. Hospital Clínic Barcelona.
Los médicos salen en defensa de las CAR-T: "Vemos tumores porque los pacientes siguen vivos"
Hematólogos e inmunólogos afirman que sus beneficios superan a los posibles riesgos, pues se están utilizando cuando no hay más opciones.
19 junio, 2024 02:35"Solo se les puede haber encontrado tumores porque están vivos; si hubieran muerto, no los habríamos visto". Así de contundente se expresa Manel Juan, jefe de Inmunología en el Hospital Clínic de Barcelona, ante la posibilidad de que las terapias CAR-T puedan provocar tumores secundarios en un pequeño número de casos.
Sabe de lo que habla: Juan es uno de los líderes del proyecto ARI para crear este tipo de terapias desde su hospital. Ya tienen una aprobada y están investigando más.
El proyecto se llama así por Ari Benedé, una chica con leucemia linfoblástica aguda cuyo activismo impulsó la investigación de estas terapias. Ella murió por este cáncer con 18 años, en 2016, por lo que no tuvo la 'oportunidad' de desarrollar un tumor secundario.
"Hay una tendencia a decir que todo lo nuevo es malo y que todo lo conocido es bueno", continúa el inmunólogo. "En este caso, los pacientes de CAR-T no tienen otras opciones, pero nadie se preocupa por las quimioterapias, que se sabe que pueden generar nuevos tumores en un porcentaje de casos".
En los últimos meses, las terapias CAR-T han estado en el punto de mira. El pasado noviembre, la agencia estadounidense de medicamentos, conocida como FDA, anunció que analizaría el riesgo que tienen de provocar nuevos tumores tras constatar 19 casos sospechosos.
[Sanidad recomienda vigilar a pacientes tratados con CAR-T ante la aparición de neoplasias]
En seguida, la agencia europea (EMA) pidió datos y ya en enero comunicó que investigaba 23 casos (los 19 observados por la FDA y cuatro nuevos) por su posible relación con estos tratamientos.
Al igual que otras de las llamadas terapias avanzadas (que se basan en la manipulación del ADN, células o tejidos), desde un principio existía el temor de que pudieran provocar nuevos tumores.
Ha sido este lunes cuando el Comité para la Evaluación de Riesgos de Farmacovigilancia (PRAC) de la EMA se ha pronunciado. De 42.500 tratamientos analizados, solo detectaron 38 tumores secundarios —es decir, que no tienen que ver con el cáncer original— originados en las células, el objetivo de la terapia.
De ellos, solo 7 revelaron la presencia del constructo CAR, la proteína nueva que implanta la terapia, lo que "sugiere que el medicamento CAR-T estaba involucrado en el desarrollo de la enfermedad".
Siete casos en 42.500 tratamientos. El 0,016% del total.
Seguimiento de por vida
Con todo, el PRAC ha emitido nuevas recomendaciones informativas para los profesionales sanitarios y conmina a hacer un seguimiento a lo largo de toda la vida a los receptores de estas terapias para rastrear la presencia de nuevos tumores.
"Es algo que siempre se hace con las terapias génicas", explica Manel Juan, que ejerce de portavoz de la Sociedad Española de Inmunología (SEI). "Incluso, cuando no es algo obligado en otros supervivientes de neoplasias, hay muchos pacientes que están más tranquilos si siguen yendo a revisión".
Las CAR-T son un tipo de terapia celular. Consiste en la extracción de linfocitos T (un tipo de célula del sistema inmune) del paciente, que se modifican en el laboratorio y se reintroducen para luchar contra la enfermedad.
En España hay cuatro terapias CAR-T industriales aprobadas y una pública, la desarrollada por el Clínic de Barcelona. Todas ellas (además de otras dos terapias comerciales más, aprobadas en Europa pero que de momento no han llegado a nuestro país) están indicadas para cánceres hematológicos: linfoma B difuso de células grandes, linfoma de células de manto, mieloma múltiple y leucemia linfoblástica aguda.
Se trata de terapias muy caras, cuyo precio por paciente ronda los 300.000 euros. Su novedad y su coste hacen que, de momento, se tengan como última opción de tratamiento, cuando todo lo demás ha fallado.
¿De dónde viene el temor a que provoquen cánceres secundarios? La modificación genética de los linfocitos T se realiza mediante un virus (lo que se conoce como vector): los virus se reproducen introduciendo su material genético en las células y dejando que estas fabriquen nuevas versiones de sí mismos.
Los virus utilizados para modificar estas células han sido, a su vez, modificados para introducir una secuencia genética concreta, la que permite que los linfocitos T reconozcan y ataquen las células cancerígenas, y, además, no se puedan reproducir.
El único momento dado al azar es que se desconoce el lugar exacto en el que el virus realiza su inserción, por lo que puede afectar a la multiplicación celular posterior, una ventana de incertidumbre que ha sido definida por los estudios.
En abril, la FDA anunció que debería vigilar de por vida la presencia de tumores secundarios en pacientes sometidos a tratamientos CAR-T pero no especificó más.
Trasplantes de médula
Justo antes de que la EMA publicara sus conclusiones, un análisis del Centro Médico de la Universidad de Standford publicado en la revista New England Journal of Medicine concluyó que, de 724 pacientes tratados desde 2016 y tras una mediana de seguimiento de 15 meses, solo se detectó un linfoma de células T, cuya relación con el tratamiento CAR-T fue descartada posteriormente.
Expertos consultados por el Science Media Centre analizaron el trabajo y concluyeron lo mismo: el riesgo de tumores secundarios asociados a terapias CAR-T no es cero pero la probabilidad de desarrollarlo es mínima.
"Vuelvo a decir que no sabemos cuántos de los pacientes no tratados con CAR-T hubieran desarrollado tumores de haber seguido vivos", recalca con ímpetu Manel Juan, "por toda la quimioterapia que han recibido previamente".
Por su parte, Marina Bastos, hematóloga del Hospital Gregorio Marañón y miembro de la junta directiva de la Sociedad Española de Hematología y Hemoterapia (SEHH), recalca que "no está demostrado que los casos de linfomas de células T estén provocados por la terapia".
Incluso en los casos en que se observó el constructo CAR, sostiene, no quiere decir que sea el responsable del desarrollo del nuevo tumor. "Se trata de una hipótesis pero sirve para que los médico estemos atentos a que hay que seguir a estos pacientes de por vida".
Las terapias CAR-T son muy recientes: la primera en España se puso en 2019. Al ser algo tan nuevo, "el seguimiento a largo plazo no está todavía definido". En linfoma B difuso de células grandes, por ejemplo, tras cinco años en remisión la probabilidad de recaída es muy baja y el paciente se suele considerar curado.
Por eso, la instrucción de la EMA es importante: señala que los pacientes deben seguir estando vigilados a pesar de que la probabilidad de recaída sea muy baja.
En España, son una veintena los centros que dan este tipo de terapias y muchos pacientes vienen referidos de otros hospitales más pequeños. "Cuando vuelven, puede no haber un experto en neoplasias hematológicas en el centro, por lo que el seguimiento puede perderse".
"Es algo que no está tan estipulado ni tan cerrado, por eso es prudente remarcar la obligatoriedad de un seguimiento a largo plazo, de manera indefinida".
Para Manel Juan hay otra cuestión de fondo tras estas sospechas. Las terapias CAR-T están consideradas como un medicamento pero se asemejan más a un trasplante de médula ósea, algo que hacen muchos hospitales sin necesidad de acudir a un laboratorio comercial.
El único aspecto que los diferencia es que la transformación de los linfocitos T se hace en un centro laboratorio farmacéutico externo.
"La persona que se va a morir no va a reclamar nada, evidentemente, pero los que no estamos enfermos nos tendríamos que preocupar de si es éticamente correcto que una empresa sea propietaria de tus células y te las venda luego".
El siguiente paso es que no haga falta utilizar las células del paciente. Ya hay ensayos con CAR-T completamente homogeneizadas: los linfocitos T procedentes de un donante son 'limpiados' y modificados de forma que puedan introducirse en cualquier paciente sin temor al rechazo.
Así, opina Manel Juan, se conseguiría homogeneizar las CAR-T e igualarlas a un medicamento, en lugar de hacerlo a un trasplante de médula ósea. Pero, ¿afecta eso a los resultados?
"A la industria farmacéutica le gusta que los productos sean alogénicos, de donante, en lugar de que sean del propio paciente", sostiene. "Esto les económicamente rentable" y, si pueden imponer su modelo de producto unificado frente a los trasplantes de médula 'descentralizados', saldrán beneficiados.
"Al final se utiliza el miedo para mover estas cosas, pero tenemos información de muchos año de trasplante y no haría falta otro sistema. Pero se decidió que las CAR-T fueran fármacos y aquí es donde estamos".